药物治疗:RAS 靶向治疗癌症的研究进展
关注我们,为您推送更多最新资讯。

文章引言
RAS 蛋白是小的 GTP 酶,在 GDP 结合 (非活性) 和 GTP 结合 (活性) 构象之间循环。GTP-RAS 激活了几种下游信号级联,其中研究最充分的是 MAPK (RAF/MEK/ERK) 和 PI3K (PI3K/AKT/mTOR) 通路。GTP 水解受损,导致下游途径的通量增加,是致癌 RAS 的一个关键特性。然而,不同的突变导致不同的生化和结构性质。大约 20% 的恶性肿瘤在 RAS 亚型中存在激活突变。尽管如此,目前仍缺乏用于治疗用途的 RAS 靶向剂。最近,对 KRAS-G12C 生化特性的表征及其“switch-II 口袋 (Switch-II Pocket)”的发现使得有效的突变体特异性抑制剂得以开发。目前有 7 个 KRAS-G12C 抑制剂正在进行临床试验,sotorasib 成为第一个获得 FDA (美国食品药品管理局) 批准的药物。
基于此,来自英国弗朗西斯克里克研究所的 Miriam Molina-Arcas 及其团队在 Genes 期刊上发表的文章,讨论了直接靶向 RAS 的发展历程和靶向 RAS 效应信号的方法,旨在讨论克服原发性耐药性和延长反应持久性的联合疗法以及新兴方法。
主要内容
在这篇综述中,作者讨论了靶向致癌 RAS 的初始方法,包括法尼酰基转移酶抑制剂和 RAS 效应通路的小分子抑制剂;接着介绍了很有潜力的 KRAS-G12C 抑制剂的开发 (图 1),这是一种处于晚期临床试验中的分子;最后简要讨论了该领域的新兴方法。
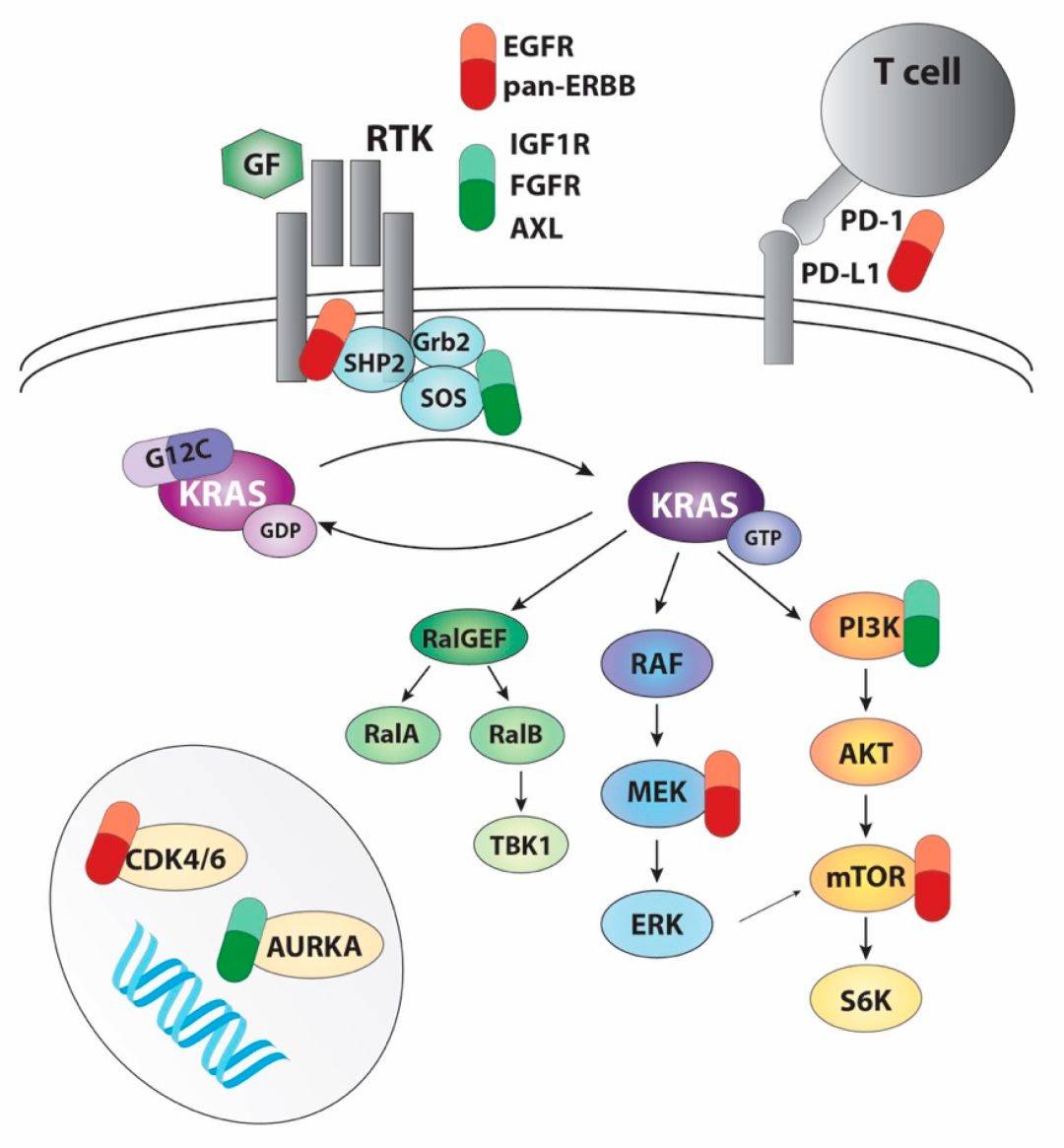
图 1. 已提出的用于提高 KRAS-G12C 抑制剂疗效的组合的概述。
多年以来,RAS 被认为是不可药治的,然而 KRAS-G12C 特异性抑制剂的开发带来了新的转机。科学家们再次投身于靶向 RAS 的研究中。在发现 RAS 近四十年后,KRAS-G12C 抑制剂获得监管批准,这将改变携带这种突变的患者的治疗前景。然而,早期的临床数据和之前使用其他靶向疗法 (如 BRAF 和 EGFR 抑制剂) 的经验表明,预计这些抑制剂作为单一疗法的疗效有限;因此,治疗将需要组合策略。然而,主要的挑战将是确定哪种组合策略最适合每种类型的肿瘤,以及确定哪些患者可以从每种策略中受益的生物标志物。此外,KRAS-G12C 抑制剂的早期临床数据表明,与肺癌相比,结直肠癌对 KRAS 抑制的耐受性更高,这表明此类肿瘤可能需要采用不同的方法。未来的主要挑战之一是明确相关的抵抗机制以及如何应对这些机制。
研究结论
KRAS-G12C 抑制剂开发过程以及对 RAS 蛋白循环构象的的研究进展有助于鉴定针对其他 RAS 等位基因的抑制剂。针对 KRAS-G12D (最普遍的突变之一) 的药物是最先进的,包括 Mirati 的抑制剂 MRTX1133,该药物正在朝着人体研究方向发展。泛 RAS 特异性药物也正在开发中,以靶向携带没有特异性抑制剂的突变的肿瘤。RevolutionMedicines 和 Boehringer ngelheim 公开披露了此类化合物。然而,这类抑制剂将面临因阻断非肿瘤细胞中的 RAS 活性而可能引起的毒性的额外挑战。
这些是 RAS 研究的激动人心的时刻,因为 RAS 抑制剂的开发也有助于更好地了解 RAS 生物学。从基础研究和临床研究中获得的知识的整合使我们走到了这一步,并最终使我们能够从 RAS 中撕去“不可用药”的标签。
原文出自 Genes 期刊
Molina-Arcas, M.; Samani, A.; Downward, J. Drugging the Undruggable: Advances on RAS Targeting in Cancer. Genes2021, 12, 899.
Genes期刊介绍
主编:J. Peter W. Young, University of York, UK
期刊主题涵盖了与 DNA、RNA、染色体、基因、遗传学和多组学相关的所有内容。下设 18 个专题,从人类、动物、植物、微生物、分子遗传、种群进化和高新技术等多个角度全方位审视遗传学和基因组学的前沿研究。
2021 Impact Factor:4.141
2021 CiteScore:5.0
Time to First Decision:17.1 Days
Time to Publication:36 Days

